Tim BIP
Tabel Periodik Unsur Kimia
Makin Hemat dengan Bebas Biaya Pengiriman Rp0.
Pilih toko Gramedia terdekat dan opsi pengiriman “Ambil di Toko” ketika checkout.
Format Buku
Deskripsi
Deskripsi
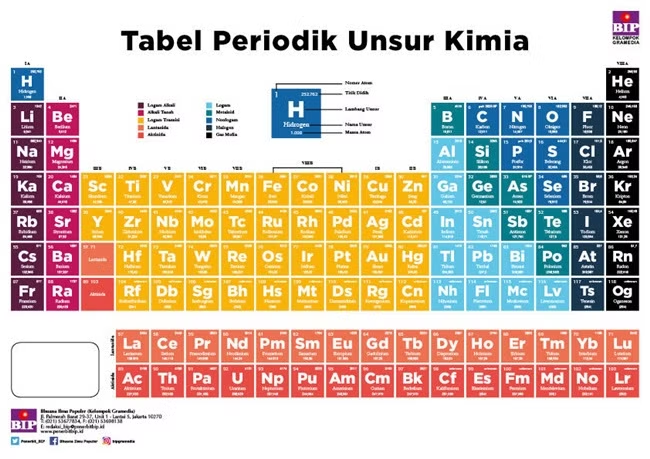
Tabel periodik, juga dikenal sebagai tabel periodik unsur (kimia), adalah tampilan tabular dari unsur-unsur kimia. Tabel ini banyak digunakan dalam kimia, fisika, dan ilmu-ilmu lainnya, dan umumnya dipandang sebagai ikon dari kimia. Tabel ini merupakan rumusan grafik dari hukum periodik, yang menyatakan bahwa sifat-sifat unsur kimia menunjukkan ketergantungan periodik pada nomor atomnya.
Tabel Periodik Kimia berisikan:
Tabel ini dibagi menjadi empat area persegi panjang yang disebut blok.
Baris-baris tabel disebut periode, dan kolom-kolomnya disebut golongan.
Unsur-unsur dari golongan yang sama dari tabel periodik menunjukkan karakteristik kimia yang serupa.
Tren berjalan melalui tabel periodik, dengan karakter nonlogam (menjaga elektronnya sendiri) meningkat dari kiri ke kanan dalam satu periode, dan dari bawah ke atas melintasi satu golongan, dan karakter logam (menyerahkan elektron ke atom lain) meningkat ke arah yang berlawanan. Alasan yang mendasari tren ini adalah konfigurasi elektron atom.
Tabel periodik terus berkembang seiring dengan kemajuan ilmu pengetahuan. Di alam, hanya unsur sampai nomor atom 94 yang ada; untuk melangkah lebih jauh, perlu untuk mensintesis unsur baru di laboratorium. Saat ini, semua 118 unsur pertama telah diketahui, melengkapi tujuh baris pertama tabel, tetapi karakterisasi kimia masih diperlukan untuk elemen terberat untuk memastikan bahwa sifat mereka cocok dengan posisinya. Belum diketahui seberapa jauh tabel akan terbentang di luar tujuh baris ini dan apakah pola bagian tabel yang diketahui akan berlanjut ke wilayah yang tidak diketahui ini.
Unsur-unsur pada golongan A merupakan golongan utama, sedangkan golongan B dinamakan logam transisi. Dua deret dari bagian bawah merupakan logam transisi dalam yang terdiri atas lanthanide dan aktinida.
Golongan IA (alkali, kecuali H), terdiri dari H, Li, Na, K, Rb, Cs, Fr;
Golongan IIA (alkali tanah), terdiri dari Be, Mg, Ca, Sr, Ba, Ra;
Golongan VIIA (halogen), terdiri dari F, Cl, Br, I, At;
Golongan VIIIA (gas mulia), terdiri dari He, Ne, Ar, Kr, Xe, Rn;
Golongan IIIA (boron-aluminium), terdiri dari B, Al, Ga, In, Ti;
Golongan IVA (karbon-silikon), terdiri dari C, Si, Ge, Sn, Pb;
Golongan VA (nitrogen-fosforus), terdiri dari N, P, As, Sb, Bi;
Golongan VIA (oksigen-belerang), terdiri dari O, S, Se, Te, Po;
Golongan IB sampai dengan VIIIB disebut golongan transisi.
Terdapat 7 periode dalam tabel periodik, dimana masing-masing tabel mewakili tingkat energi atom yang dimiliki. Tidak semua periode memiliki jumlah unsur yang sama. Di mana jumlah unsur terkecil terdapat pada periode 1 yang berjumlah 2 unsur. Sedangkan jumlah unsur terbanyak adalah pada periode 6 yang memiliki 32 unsur.
Periode ke-1, 2 unsur
Periode ke-2, 8 unsur
Periode ke-3, 8 unsur
Periode ke-4, 18 unsur
Periode ke-5, 18 unsur
Periode ke-6, 32 unsur, 18 unsur seperti periode ke-4 dan ke-5, 14 unsur deret lantanida
Periode ke-7, merupakan periode unsur yang belum lengkap. Terdapat deret aktinida.
Berikut ini adalah sifat-sifat dalam Sistem Periodik Unsur Kimia yang terkandung :
Sifat Unsur
Jari-Jari Atom
Kereaktifan
Energi Ionisasi
Afinitas Elektron
Keelektronegatifan
Informasi lain :
Lebar : 14.8 cm
Panjang : 21 cm
Berat : 0.069 kg
ISBN : 9786232166011
Pengarang : Tim Redaksi Bip
Penerbitan : Jakarta: Bhuana Ilmu Populer
Tanggal terbit : 21 Oktober 2019
Bahasa : Indonesia
Subjek : Unsur kimia
Bentuk Karya : Bukan fiksi
Status : Aktif
Baca Selengkapnya
Detail Buku

Tim BIP
Tabel Periodik Unsur Kimia